Covid-19: procedimento da Anvisa deve acelerar registro de vacina
Segundo a agência, os diretores dispensaram a análise de impacto regulatório e consulta pública para o registro devido ao grau de urgência da vacina e gravidade da doença.
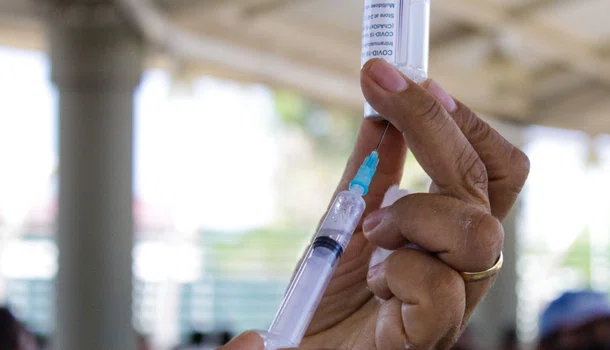
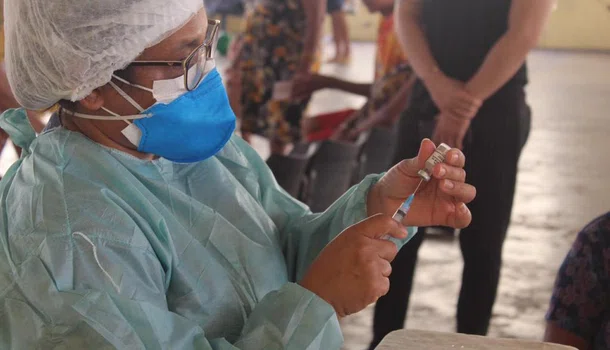
A Agência Nacional de Vigilância Sanitária (Anvisa) definiu procedimentos de submissão contínua de dados técnicos para o registro de vacinas contra a covid-19. A Instrução Normativa nº 77/2020 foi aprovada nessa terça-feira (17), pela diretoria colegiada do órgão e publicada nesta quarta-feira (18) no Diário Oficial da União.
Em comunicado a Anvisa informou que essa medida possibilitará acelerar a disponibilização de vacinas contra o novo coronavírus, para a população brasileira, desde que demonstradas qualidade, segurança e eficácia conforme os requerimentos técnicos e regulatórios vigentes.
Segundo a agência, os diretores dispensaram a análise de impacto regulatório e consulta pública para o registro devido ao grau de urgência da vacina e gravidade da doença. O procedimento será normatizado apenas para as vacinas contra covid-19 a serem registradas no país.
A proposta da Anvisa prevê o atendimento a dois critérios para uso desse procedimento diferenciado. Um deles se refere à exigência de um dossiê de desenvolvimento clínico de medicamento referente à vacina proposta, protocolado na agência. Outro critério é que a pesquisa esteja em fase 3 de desenvolvimento clínico.
A instrução normativa publicada pela Agência, diz que a empresa solicitante do registro poderá procurar a Coordenação de Produtos Biológicos para discutir aspectos relacionados ao desenvolvimento do produto, antes da submissão da documentação de registro.
FMS de Teresina fará 3º mutirão de consultas e exames neste sábado
Segundo a FMS, o mutirão é voltado para pacientes que já estão aguardando consulta pelo Sistema Único de Saúde (SUS) em Teresina, e tem por objetivo reduzir a fila de espera.Mais de 80% dos pacientes do HUT vítimas de acidentes de trânsito são motociclistas
Conforme o hospital, observa-se uma predominância significativa do sexo masculino, representando 74% dos casosApenas 13% do público alvo tomou vacina contra a gripe em Teresina, diz FMS
Até o dia 21 de abril foram aplicadas em Teresina o total de 34.054 doses de vacina contra a gripe, atingindo apenas 13,85% da população alvo (323.616 pessoas).FMS de Teresina imuniza venezuelanos contra a gripe em abrigos
De acordo com a Fundação Municipal de Saúde, a ação aconteceu nesta quinta-feira (18) e visa ampliar as taxas de vacinação neste público alvo.Hospital de Urgência de Teresina faz seleção para Projeto em Fisioterapia
O resultado final será divulgado no dia 07 de junho, com início das atividades previsto para o dia 24 de junho







E-mail
Messenger
Linkedin
Gmail
Tumblr
Imprimir